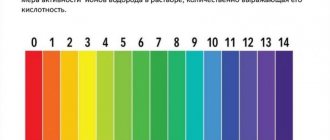
Что такое жесткость воды
Оксид водорода (вода) — самая распространенная жидкость на земле, обладающая уникальными свойствами растворять в себе многие химические элементы и соединения. Понятие жесткости воды в определении трактуется как количественный показатель концентрации солей щелочноземельных и иных металлов. Преимущественно это соединения кальция и магния.
Термин общая жесткость воды возник в результате наблюдений за состоянием тканей после стирки. Особая структура материала, состоящего из отдельных нитей, способствует накоплению упомянутых солей металлов. При большом их содержании ткань, становится жесткой и грубой. Позже было замечено, что высокая концентрация таких соединений существенно снижает эффективность моющих средств.
Жесткость воды — это соли кальция и магния, образующие накипь на внутренних поверхностях нагревательных приборов и теплообменников. Это в свою очередь приводит к ухудшению эксплуатационных и экономических характеристик нагревательного оборудования. В отдельных случаях трубопроводы в буквальном смысле закупориваются, что делает невозможным их использование по назначению. Определить есть ли в воде жесткость можно даже в домашних условиях!
Способы умягчить воду
Известны несложные способы по смягчению воды в условиях дома собственными руками. Для подбора метода нужно определиться с какой целью будет подготавливаться вода – для купания деток, стирки, для приготовления пищи, для аквариума либо для прочих хозяйственных запросов.
Для смягчения водицы в больших объёмах советуется монтировать особые устройства – фильтры для умягчения воды с врезкой в систему водопровода или функционирующие независимо.
Понизить уровень жёсткости воды в условиях дома возможно следующими способами:
- Отстаивание – простой способ в исполнении. Резервуар с водой ставится в сторонку на 1-2 суток, подальше от лучей солнца. Отстоявшаяся вода нередко используется для поливки комнатных и огородных насаждений. Пополнение воды для этих нужд осуществляется из скважин или колодцев.
- Кипячение – самый несложный метод очищения воды от жёстких соединений без использования химии и органики. Нагревание до большой температуры влияет на распад солей и приводит к оседанию их на днище посуды. В этом простом методе теряются полезные свойства воды для питья, повышается затрата энергии, придётся убирать накипь.
- Заморозка – этот способ основывается на частичном замораживании жёсткой жидкости. Водица наливается в ёмкость необходимых габаритов и устанавливается в охлаждающую камеру. При образовании на плоскости резервуара ледяного шара, оставшаяся вода выливается. Возникший лёд при оттаивании станет подходящим для питья. Полезные качества не пропадут, а нехорошие примеси отойдут.
Основные причины образования жесткости воды
Фактически эта жидкость является универсальным растворителем, который при контакте с почвой и минералами насыщается содержащимися в ней веществами и химическими соединениями. Отвечая на вопрос о жесткости воды, и чем она обусловлена, необходимо выделить основные источники солей щелочноземельных металлов:
- Для подземных источников — это пласты известняка, сквозь которые просачивается жидкость.
- Для открытых водоемов и приповерхностных слоев — это геологические породы: природный гипс, доломит и другие.
- Ионы кальция и магния насыщают воду в результате химических реакции диоксида углерода и некоторых минералов.
- Микробиологические процессы в грунтах и на сельскохозяйственных угодьях в районах водосбора.
Помимо естественных причин повышенное содержание ионов жесткости в воды обусловлено также и техногенными. В составе стоков промышленных, строительных и коммунальных предприятий имеется большое количество примесей. В результате происходит вторичное загрязнение водоемов и водоносных слоев.
Естественные процессы химического выветривания горных пород и техногенные факторы определяют параметры жесткости воды питьевой или технической. Эти показатели неодинаковы для различных источников и постоянно изменяются:
- Повышаются в результате испарения влаги с открытых поверхностей водоемов.
- Снижаются при выпадении атмосферных осадков, таянии льдов и снега.
Значительное содержание извести в воде — это жесткость преимущественно естественного происхождения, характерная для подземных источников, в том числе и для артезианских скважин. Минерал вымывается из геологических пластов потоками жидкости при просачивании вглубь земной коры. Затем этот раствор через родники и ключи пополняет водный баланс открытых источников.
Происходит постоянный кругооборот, и жесткость воды в некоторой степени зависит от времени года. Весной в ходе таяния снегов и активных осадков он существенно уменьшается в другие периоды и, особенно при засухах — увеличивается.
Зачем смягчать воду
Для разных регионов, свойственной чертой является жёсткая вода. К необходимости умягчать воду прибегают много людей. Образующийся на дне чайника налёт показывает о трудности с жёсткостью воды.
Нередко это обнаруживается при пользовании водой из артезианской скважины, ведь уровень жёсткости воды в основном выказывается содержанием в ней кальция с магнием. Данные минеральные соединения создают карбонатную жёсткость разной воды.
- Умягчить жидкость с временной жёсткостью получится за 1 ч, прибегнув к процедуре кипячения. Карбонат со стенок опустится на дно посуды в виде белёсого осадка.
- Однако если воду с временной жидкостью путём кипячения можно смягчить, то этот способ не работает в отношении постоянной жидкости, образованной солями сульфатов и кальция. Эти соли не смогут раствориться.
- Большая жёсткость, идущей на питьё воды, наделяет её горьким вкусом, а её потребление может нанести урон состоянию здоровья. Она способна произвести сбои в работе желудка и кишечника.
- В бытовых условиях такая вода приведёт к порче машин по стирке и мойке посуды, бойлера, а также чайника. Ещё замечено отрицательное влияние на трубы сантехники, они засоряются и быстрее приходят в негодность под влиянием чрезмерно жёсткой воды.
Отмечая всё вышесказанное – стоит смягчить уровень жёсткости водицы, а именно понизить кальциево-магниевые соединения в ней.
Виды жесткости воды
Уровень содержания солей и их состав для разных источников водоснабжения как открытых, так и закрытых различаются и существенно. Возникает закономерный вопрос, а какова жесткость воды, и какой она может быть в зависимости от происхождения. Существует классификация по уровню насыщенности химическими веществами и соединениями, для удобства сведенная в таблицу:
| Наименование | мг∙экв/л | Градусы °dH | ppm |
| Очень мягкая | не более 1,5 | 0-4° | 0-70 |
| Мягкая | от 1,5 до 4,0 | 5-8° | 70-140 |
| Средней жесткости | от 4,0 до 8,0 | 9-12° | 140-210 |
| Жесткая | от 8,0 до 12,0 | 13-22° | 210-320 |
| Очень жесткая | свыше 12,0 | 23-34° | 320-530 |
Приведенная шкала наглядно показывает уровни жесткости воды, и в чем она измеряется в системах, принятых в разных государствах. Данная классификация отображает методические подходы к определению означенного показателя в соответствии с нормативными документами следующих стран:
- Россия. Государственный стандарт.
- Германия. Институт стандартизации — DIN.
- США. Агентства по охране окружающей среды Соединенных Штатов Америки — USERA.
Упомянутый градус жесткости воды — это единица измерения, принятая в западных странах. Этот показатель соответствует следующим значениям:
- В Германии (°dH). Одна часть CaO или 0,719 части MgO на 100 тыс. частей воды.
- В Британии (°e). 1 гран CaCO3 на один галлон жидкости.
- В США (ppm) и Франции (°TH). Одна часть CaCO3 на 100 тыс. частей воды.
При сравнительно невысоком уровне жесткости воды содержание ионов кальция в ней может достигать 70-80%, в тоже время насыщенность ионами магния редко превышает 50-60%. При увеличении уровня минерализации картина резко меняется: концентрация первых сильно уменьшается и редко доходит до 1 г/л; содержание же ионов магния часто превышает показатель 10 г/л. Такое соотношение особенно характерно для соленых озер, не имеющих стока.
Классификация вод осуществляется не только по уровню жесткости, но и с учетом ее гидрохимического состава. По данному признаку различают следующие разновидности:
- Общая.
- Временная (карбонатная).
- Постоянная (не карбонатная).
Для каждого типа характерно определенное соотношение содержания солей кальция, магния и других. Соответственно методы уменьшения жесткости воды зависят от ее вида, и состав оборудования для конкретного случая определяется с учетом реальных показателей. Рассмотрим этот вопрос подробнее.
Общая жесткость воды
Исследуемый показатель в значительной мере зависит от гидрохимического состава жидкости и уровня насыщения солями кальция и магния. Общая жесткость — это свойство воды, определяемое суммарным содержанием гидрокарбонатов и других соединений названных элементов. Данная характеристика имеет две составляющие:
- Карбонатная (временная). Связана с наличием в жидкости гидрокарбонатов кальция (Ca2+) и магния (Mg2+), которые при нагревании и кипячении образуют CaCO3 и Mg(OH)2 с выделением углекислого газа (CO2).
- Некарбонатная (постоянная). Определяется присутствием фосфатов, хлоридов, сульфатов, силикатов и нитратов этих щелочноземельных металлов.
Перечисленные соли, определяющие общую жесткость воды, при кипячении не разлагаются и их удаление из жидкости требует иных методов. Для численного выражения этого показателя используют специальную физическую единицу 1 ммоль-экв./л, которая соответствует содержанию 20,04 мг/л катионов кальция либо 12,16 мг/л катионов магния.
Общая жесткость подземных вод (в некоторых регионах), а также морских и океанских может достигать 80 и даже 100 ммоль-экв/л, что делает их непригодными для использования. В тоже время в реках и озерах, находящихся в таежных районах данный показатель находится на уровне от 0,1 до 0,2 ммоль-экв/л. Такой водой практически невозможно смыть мыльный раствор.
Временная жесткость (карбонатная)
Природная вода содержит значительное количество катионов щелочноземельных металлов. Временная (магниевая и кальциевая) жесткость воды — это показатель присутствия в жидкости гидрокарбонатов названных химических элементов. При нагревании растворимость этих соединений (при уровне pH превышающем 8,3 единицы) существенно уменьшается, и они переходят в следующие формы:
- осадок хлопьевидный;
- беловатая пленка на поверхности;
- кристаллическая накипь.
Временная жесткость воды по кальцию и магнию при этом полностью устраняется — отсюда собственно и название. Помимо кипячения уменьшить означенный показатель возможно используя ионообменные методы и технологии обратного осмоса.
Постоянная жесткость (некарбонатная) воды
Помимо гидрокарбонатов кальция и магния в источниках водоснабжения присутствуют в значительных количествах соли азотной, серной и соляной кислоты. Под некарбонатной жесткостью воды подразумевается суммарное содержание этих химических соединений. Последние при нагревании остаются в растворенном состоянии и не выпадают в осадок.
Некарбонатная жесткость воды именно поэтому и называется постоянной, а для ее устранения необходимо специальное оборудование. Существенно уменьшить концентрацию этих растворимых соединений возможно при использовании ионообменных технологий и деминерализации. Особенно высока эффективность у современных систем умягчения.
Отличие временной и постоянной жесткости
Временная жесткость – это примесь в водопроводной воде соединений магния и кальция, которые носят название гидрокарбонатов и карбонатов. При проведении процедуры кипячения этой воды соединения распадаются, тем самым оседая на стенках чайника в виде накипи. Получается, что при кипячении жесткость самоустраняется, поэтому и носит название временной.
Постоянная жесткость – когда в воде наличие солей магния и кальция образуют соединения с сильными кислотами, такими как азотная, серная или соляная. Как бы сильно хозяйки не кипятили чайник, эти примеси в воде после кипячения никуда не исчезнут.
Временная и постоянная жесткость в других источниках могут именоваться карбонатная и не карбонатная жесткость воды соответственно. Одна и та же вода может обладать сразу двумя этими характеристиками, а их сумма носит название «суммарной жесткости».
Действующие нормативы жесткости воды
Нормы жесткости, характеризующие качество источников водоснабжения, регламентируются во всех развитых странах. В Российской Федерации принят ГОСТ 31954-2012, которым устанавливаются предельные значения общей жесткости воды и определяются способы ее вычисления. Этим документов утверждены два метода: комплексонометрический — основной и атомной спектрометрии — арбитражный.
Жесткость общая воды в части гигиенических норм устанавливается требованиями СанПиН 2.1.4.1075-01, утвержденным Постановление от 26.09.2001 года. Суммарный показатель содержания солей щелочноземельных металлов не должен превышать предельно-допустимых концентраций, которые определены в размере 7,0 и 10,0 мг-экв./л. Второе значение может быть установлено только по решению главного санитарного врача с учетом используемой технологии водоподготовки для конкретного населенного пункта.
СОДЕРЖАНИЕ
- 1 Происхождение
- 2 Постоянная твердость 2.1 Временная твердость
- 3.1 Размягчение
- 4.1 Жесткая / мягкая классификация
- 5.1 В Австралии
Расчет жесткости воды
При определении общей жесткости воды допускается применение вычислительных методов. Этот показатель измеряется в ммоль/дм3 или моль/м3 и описывается следующей формулой:
ЖО = [Ca2+] + [Mg2+] = ЖК + ЖНК;
Данное уравнение позволяет вычислить среднюю жесткость воды, в ней приняты следующие обозначения:
ЖО — общая.
ЖК — карбонатная (временная).
ЖНК — некарбонатная (постоянная).
Для того чтобы рассчитать общую жесткость воды необходимо знать молярную масса катионов кальция и магния, а также анионов сернистой кислоты. Результаты вычислений могут быть использованы для определения наиболее подходящего метода ее очистки. Подобные расчеты проводятся специалистами профильных лабораторий на основании опытных данных.
Влияние на здоровье человека:
Как же влияет жесткая вода на наш организм? Медики связывают появление мочекаменной болезни именно с этой особенностью воды. Но на данный момент официального подтверждения этой гипотезе нет. Но мы знаем, что слишком жесткая вода неблагоприятно влияет на органолептические свойства воды, придавая ей горьковатый вкус. Также жесткая вода сушит нашу кожу и волосы. Однако, полностью переходить на мягкую воду не рекомендуется. Наш организм нуждается в солях кальция и магния для укрепления сердечно-сосудистой системы. А вот комнатные растения лучше поливать мягкой или талой водой.
Методы определения уровня жесткости воды
Как определить жесткость воды? Точная оценка количественных параметров содержания солей производится специализированными лабораториями. В соответствии с ГОСТ 31954-2012 общая жесткость воды определяется комплексонометрическим методом в такой последовательности:
- Проба разделяется на две равные части.
- В химическую колбу наливают 100 мл исследуемой воды, добавляют к нему 5 мл буферного раствора и сухой индикаторной смеси в количестве 0,06-0,10 г. Получившийся состав титруется трилоном Б.
- Аналогичные действия выполняются в отношении второй части пробы в другой лабораторной посуде. Добавление трилона Б осуществляется в два приема: сначала — на 0,5 см3 меньше, чем при исследовании первого образца. После тщательного перемешивания вводится остаток.
Обработка результатов, полученных с использованием описанного метода определения общей жесткости воды, выполняется по следующей формуле:
Ж = M•K•Vтp/Vnp,
где M — коэффициент пересчета;
K — коэффициент поправочный;
Vтp — объем трилона Б, использованного для титрования;
Vnp — количество исследуемой воды из пробы.
Результат испытаний согласно данному методу определения общей жесткости в питьевой воде, а также технической, вычисляется как среднеарифметическое от двух полученных значений. Это позволяет минимизировать погрешность расчетов.
Технические устройства
Использование техники уменьшает затраты времени, и даёт возможность очищать немалые объёмы жидкости.
- Пластинчатый фильтр. Прибор построен на не химическом способе очистки влаги. Установка фильтра в виде двухсторонних магнитов проводится на разных водопроводах. С помощью образовавшегося магнитного поля, частицы соли удерживаются и направляются в отстойники. Вода умягчается, но не понижается её качество.
- Фильтровальный кувшин. Приобрёл популярность за счёт недорогой стоимости и простого устройства. Барьером для вредных веществ служит заменяемый картридж с угольным наполнителем. Отталкиваясь от частоты использования и жёсткости водицы, смена фильтра понадобится раз в два месяца.
- Устройство с ионообменной смолой. Подсоединяемая к системе водопровода установка содержит две ёмкости. В первом резервуаре вода очищается смолами, а переходя во второй – умягчается солевым раствором. Время от времени нужна замена химических компонентов фильтра, агрегат нуждается в подсоединении к канализации.
- Фильтр с мембранами. Предоставляет лучшие результаты по смягчению жидкости. Вода в приборе под напором проходит сквозь фильтровальные мембраны. Вместе с умягчением – жидкость очищается от отрицательных бактерий. В итоге конкретного очищения, вместе с вредными веществами удаляются и полезные вещества. Фильтровальное устройство имеет большую стоимость, не может проделывать очистку большого количества жидкости.
В некоторых случаях можно умягчить малые количества жидкости, прибегая к народным способам. Для постоянного уменьшения жёсткости в больших количествах, потребуется покупка и подсоединение в систему специальных фильтров.
Бытовые способы умягчения воды
Высокая соленость и жесткость воды, используемой в пищу и в хозяйственно-бытовых целях, может принести вред здоровью и привести к выходу из строя бытовой техники. В домашних условиях уменьшить этот показатель можно путем термической и химической обработки исходной жидкости.
Устранимая жесткость воды — карбонатная (временная) снижается при длительном кипячении. В процессе нагрева гидрокарбонатные соединения кальция и магния распадаются и переходят в твердое состояние. Они образуют накипь на стенках посуды, хлопьевидный осадок и поверхностный налет. Последние легко удаляются фильтрованием или отстаиванием.
Химическая обработка в целях снижения жесткости исходной воды выполняется при помощи извести и соды. Первый реагент обеспечивает умягчение жидкости с незначительным содержанием некарбонатных и высокой насыщенностью карбонатными соединениями. Для повышения эффективности данного метода дополнительно применяются реагенты коагулянты.
Комбинирование извести и пищевой соды позволяет уменьшить общую жесткость речной или колодезной воды до значений 1,4-1,8 мг экв./л. Химическая обработка обеспечивает улучшение качества жидкости по данному показателю, но требует очень точной дозировки реагентов. Кроме того она непригодна для приготовления пищи и питья.
Ссылки [ править ]
- «Жесткая вода» . Национальная ассоциация подземных вод . Проверено 28 июня 2021 .
- ^ a b c Жесткость питьевой воды Всемирной организации здравоохранения , 2003 г.
- ^ a b c Weingärtner, Herman] (декабрь 2006 г.). Энциклопедия промышленной химии Ульмана — Вода
. Вайнхайм: Wiley – VCH. DOI : 10.1002 / 14356007.a28_001 . - «Карта, показывающая уровень жесткости в мг / л как карбонат кальция в Англии и Уэльсе» (PDF) . DEFRA / Инспекция питьевой воды. 2009 г.
- ^ a b c USGS — Управление геологической службы США по качеству воды. «Информация о качестве воды USGS: жесткость и щелочность воды» . usgs.gov
. - Кристиан Нич, Hans-Joachim Heitland Хорст Marsen, Hans-Joachim Schlüussler, «очищающие агенты» в энциклопедии Ульмана промышленной химии 2005, Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a07_137
- Сенгупта, Паллав (август 2013). «Потенциальное воздействие жесткой воды на здоровье» . Международный журнал профилактической медицины
.
4
(8): 866–875. ISSN 2008-7802 . PMC 3775162 . PMID 24049611 . - «Смягчение извести» . Проверено 4 ноября 2011 года .
- Wisconisin DNR — Карбонатная химия
- ↑
Стивен Лоуэр (июль 2007 г.). «Жесткая вода и смягчение воды» . Проверено 8 октября 2007 . - PP Кутзее (1998). «Эффекты уменьшения масштаба и модификации масштаба, вызванные Zn» (PDF) . Архивировано из оригинального (PDF) 09 мая 2021 года . Проверено 29 марта 2010 .
- Сорг, Томас Дж .; Шок, Майкл Р .; Литл, Даррен А. (август 1999 г.). «Ионообменное смягчение: влияние на концентрацию металлов» . Журнал AWWA
.
91
(8): 85–97. DOI : 10.1002 / j.1551-8833.1999.tb08685.x . ISSN 1551-8833 . Архивировано из оригинала на 2011-07-26 . Проверено 23 ноября 2010 . - «Питьевая вода, жесткость воды, кальций, магний, окрашенное бельё» . Water-research.net . Проверено 26 января 2013 .
- Франтишек Kožíšek здравоохранения значение питьевой воды кальция и магния архивной 2013-04-18 в Wayback Machine , февраль 2003
- ↑
Pocock SJ , Shaper AG, Packham RF (апрель 1981 г.). «Исследования качества воды и сердечно-сосудистых заболеваний в Соединенном Королевстве».
Sci.Total Environ
.
18
: 25–34. Bibcode : 1981ScTEn..18 … 25P . DOI : 10.1016 / S0048-9697 (81) 80047-2 . PMID 7233165 . - Marque S, Jacqmin-Gadda Н, Dartigues ДФ, Commenges D (2003). «Смертность от сердечно-сосудистых заболеваний и содержание кальция и магния в питьевой воде: экологическое исследование у пожилых людей» (PDF) . Евро. J. Epidemiol
.
18
(4): 305–9. DOI : 10,1023 / A: 1023618728056 . PMID 12803370 . S2CID 1834547 . - Rubenowitz E, G Аксельсон, Райлендер R (январь 1999). «Магний и кальций в питьевой воде и смерть женщин от острого инфаркта миокарда». Эпидемиология
.
10
(1): 31–6. DOI : 10.1097 / 00001648-199901000-00007 . PMID 9888277 . - ↑
McNally NJ, Williams HC, Phillips DR, Smallman-Raynor M, Lewis S, Venn A, Britton J (1998). «Атопическая экзема и жесткость бытовой воды» .
Ланцет
.
352
(9127): 527–531. DOI : 10.1016 / S0140-6736 (98) 01402-0 . PMID 9716057 . S2CID 6319959 . - ↑
Miyake Y, Yokoyama T, Yura A, Iki M, Shimizu T (январь 2004 г.). «Экологическая связь жесткости воды с распространенностью детского атопического дерматита в городской местности Японии».
Environ. Res
.
94
(1): 33–7. Bibcode : 2004ER ….. 94 … 33M . DOI : 10.1016 / S0013-9351 (03) 00068-9 . PMID 14643284 . - Арнедо-Пена A, Беллидо-Бласко J, Пуч-Барбера J, Артеро-Чивера A, Кампос-Круаньес JB, Pac-Sa MR, Вильямарин-Васкес JL, Фелис-Даудер C (2007). «Жесткость бытовой воды и распространенность атопической экземы у школьников Кастельона (Испания)» . Salud Pública de México
.
49
(4): 295–301. DOI : 10.1590 / S0036-36342007000400009 . PMID 17710278 . - Перкин М.Р., Крейвен Дж., Логан К., Страчан Д., Маррс Т., Радулович С., Кэмпбелл Л.Э., МакКаллум С.Ф., Маклин У.Х., Лак Г., Флор С. «Связь между жесткостью бытовой воды, содержанием хлора и риском атопического дерматита в раннем возрасте: популяционное поперечное исследование» (PDF) . J Allergy Clin Immunol
.
138
(2): 509–516. DOI : 10.1016 / j.jaci.2016.03.031 . PMID 27241890 . - Многоцентровое рандомизированное контролируемое испытание ионообменных смягчителей воды для лечения экземы у детей: протокол испытания экземы умягченной водой (SWET) (ISRCTN: 71423189) https://www.swet-trial.co.uk/
- «Жесткость воды» . thekrib.com
. - Общая жесткость воды [ постоянная мертвая ссылка
] - ↑
Коррозия водой. Архивировано 20 октября 2007 г. на Wayback Machine. - ^ a b McTigue, Nancy E .; Саймонс, Джеймс М., ред. (2011). Водный словарь: исчерпывающий справочник по водной терминологии . Американская ассоциация водопроводных сооружений. стр. 333–. ISBN 978-1-61300-101-1.
- ^ a b Рид, Роберт Н. (2003). Системы качества воды: Руководство для управляющих объектами . CRC Press. С. 66–. ISBN 978-0-8247-4010-8.
- Ланжелье, WF (октябрь 1936). «Аналитический контроль антикоррозионной обработки воды». Журнал Американской ассоциации водопроводных сооружений
.
28
(10): 1500–1521. DOI : 10.1002 / j.1551-8833.1936.tb13785.x . JSTOR 41226418 . - Аквапрокс, изд. (2009). Обработка охлаждающей воды . Springer. С. 104–. ISBN 978-3-642-01985-2.
- Эмерсон АГД (2003). Количественное прогнозирование проблем в промышленных водных системах . World Scientific. С. 7–. ISBN 978-981-238-184-2.
- Ryznar, John W .; Ланжелье, WF (апрель 1944 г.). «Новый индекс для определения количества отложений карбоната кальция, образованных водой». Журнал Американской ассоциации водопроводных сооружений
.
36
(4): 472–486. DOI : 10.1002 / j.1551-8833.1944.tb20016.x . JSTOR 23345279 . - TE, Ларсон и Р.В. Скольд, Лабораторные исследования, касающиеся минерального качества воды и коррозии стали и чугуна, Водное обследование штата Иллинойс, 1958 г., Шампейн, Иллинойс, стр. [43] — 46: илл. ISWS C-71
- Stiff, Jr., HA, Davis, LE, Метод прогнозирования тенденции нефтяных промысловых вод к отложению карбоната кальция, Pet. Пер. AIME 195; 213 (1952).
- Оддо, Дж. Э., Томсон, МБ, Контроль масштабов, прогнозирование и лечение, или как компании оценивают проблему масштабирования и что они делают не так, CORROSION / 92, Paper No. 34 (Хьюстон, Техас: NACE INTERNATIONAL 1992). KK
- «Посудомоечная машина и жесткость воды — Качество воды в Канберре — О нас» . actewagl.com.au
. Архивировано из оригинала на 2012-03-26. - melbournewater.com.au
(PDF) https://web.archive.org/web/20130511163534/https://www.melbournewater.com.au/content/library/publications/reports/compliance_reports/public_health_compliance_quarter_1_(july-september_2006 ) .pdf . Архивировано из оригинального (PDF) на 2013-05-11 . Проверено 17 декабря 2006 . Отсутствует или пусто |title=( справка ) - «Сиднейский типичный анализ питьевой воды» . Архивировано из оригинала на 2013-01-16 . Проверено 17 декабря 2006 .
- «Водная корпорация WA — 404» (PDF) . watercorporation.com.au
. Архивировано из оригинального (PDF) 4 сентября 2007 года. - «Питьевая вода Брисбена» . Архивировано из оригинала на 2007-11-02 . Проверено 17 декабря 2006 .
- «Качество воды Аделаиды» . Архивировано из оригинала на 2013-03-15 . Проверено 30 ноября 2012 .
- «Городской совет Хобарта, Тасмания, Австралия» . hobartcity.com.au
. Архивировано из оригинала на 2008-02-10. - «Качество воды Дарвина» (PDF) . Архивировано из оригинального (PDF) 30 сентября 2007 года . Проверено 17 декабря 2006 .
- «Ville de Montréal — L’eau de Montréal» . .ville.montreal.qc.ca. 2013-01-22 . Проверено 26 января 2013 .
- Канадская ассоциация качества воды. «Жесткость воды / Общее количество домохозяйств в городах Канады» (PDF) . Архивировано из оригинального (PDF) 4 октября 2013 года . Проверено 4 октября 2013 года .
- «Часто задаваемые вопросы» . Saskatoon.ca . Проверено 26 января 2013 .
- Результаты теста качества питьевой воды в Виннипеге, 2006 г.
- «Вода — Услуги — Жизнь в Торонто — Город Торонто» . toronto.ca
. 2017-07-14. - GVRD Wash Smart — Факты о воде
- «ГОРОД ЧАРЛОТТАУН ВОДОСНАБЖЕНИЕ И КАНАЛИЗАЦИЯ Отчет о воде за 2006 год» (PDF) . Aquasafecanada.com . Проверено 26 января 2013 . [ постоянная мертвая ссылка
] - «REGION OF WATERLOO Отчет об испытаниях эффективности умягчителей воды в жилых помещениях № 1, апрель 2011 г.» (PDF) . Regionofwaterloo.ca. Архивировано из оригинального (PDF) 13.10.2017 . Проверено 26 января 2013 .
- «Уведомление для общественности: Водоснабжение Вест-Сайд | Сент-Джон» . www.saintjohn.ca
. Проверено 10 октября 2021 . - Департамент общественных работ и экологических . ottawa.ca
. Проверено 19 июня 2021 . - «Таблица 2 Жесткость питьевой воды» . United Utilities
. Архивировано из оригинала на 2012-04-13 . Проверено 3 марта 2012 . - ^ a b «Качество питьевой воды» . United Utilities
. Проверено 3 марта 2012 . - «Северн Трент Уотер — B1 1DB» . Северн Трент Уотер
. Архивировано из оригинала на 2012-05-03 . Проверено 3 марта 2012 . - «Уровень жесткости воды в Бристоле» . Бристольская вода
. Архивировано из оригинала на 2011-08-01 . Проверено 3 марта 2012 . - «Южная вода — зона SO14» . Южная вода
. Архивировано из оригинала на 2012-11-23 . Проверено 3 марта 2012 . - «EC1A 7BE — Качество воды в вашем районе» . Вода Темзы
. Архивировано из оригинала на 2012-05-27 . Проверено 3 марта 2012 . - dwi.gov.uk
- anglianwater.co.uk
- Раздел 36 «Жесткость» https://www.epa.ie/pubs/advice/water/quality/Water_Quality.pdf
- Уилсон, Эмбер; Пэрротт, Кэтлин; Росс, Блейк (июнь 1999 г.). «Качество воды в домашних условиях — жесткость воды» . Проверено 26 апреля 2009 .
- Бриггс, JC, и Фике, JF; Качество рек США, 1975 водный год — на основе Национальной сети учета качества водотоков (NASQAN)
: Отчет геологической службы США в открытом доступе 78-200, 436 стр. (1977) - «Есть жесткая вода? Вот что вам нужно знать об этом» . Пульс современного дома. 2018-01-22 . Проверено 22 сентября 2021 .
Профессиональные методы снижения жесткости воды
Качественное умягчение исходной воды до требуемого уровня возможно только при использовании специального оборудования — фильтров от жесткости воды. Довести показатели жесткости до соответствия требованиям упомянутого СанПиН и «ГОСТ вода питьевая» позволяют следующие технические устройства:
- Фильтры умягчения.
- Ионообменные фильтры.
- Системы обратного осмоса.
При выборе установки для снижения жесткости воды, прибором для ее определения устанавливают точный гидрохимический состав и количественное содержание солей. Оборудование подбирается по результатам испытаний и с учетом требований заказчика к качеству обработанной воды.
Фильтры умягчения
Процесс уменьшения общей жесткости воды должен быть достаточно эффективным и недорогим. В настоящее время основным способом умягчения является метод натрий-катионирования (фильтры умягчения), который применяется и в быту, и в промышленных масштабах. Поток воды пропускается через ионообменные колонны, где происходит замещение кальция и магния катионами натрия. На поверхности полимерных смол происходят следующие химические реакции:
Ca2+ + 2RNa = 2Na+ + R2Ca
Mg2+ + 2RNa = 2Na+ + R2Mg
В результате общая жесткость доводится до уровня питьевой воды по ГОСТу, что делает возможным ее применение для приготовления пищи и хозяйственно-бытовых нужд.
Такие фильтрующие колонны применяются в составе многоступенчатых систем, в которых вода сначала очищается от механических примесей и железа. Это позволяет повысить ресурс основных картриджей, который естественным образом уменьшается в процессе расходования ионов натрия и накопления ионов жесткости. Для восстановления свойств ионообменных смол в системе предусмотрены баки с раствором поваренной соли, клапаны и блоки управления.
Когда датчик фиксирует повышение жесткости воды в ppm, подача ее перекрывается и производится обратная промывка содержимого колонны солевым раствором. После восстановления характеристик полимерных гранул, подача реагента прекращается. Открывается клапан и возобновляется процесс умягчения.
Управление работой такого фильтра, обеспечивающего уменьшение общей жесткости природной воды, в зависимости от комплектности осуществляется в автоматическом или в ручном режиме. В первом варианте используются электронные датчики и электроклапаны. Во втором случае переключение установки в режим регенерации выполняется человеком по истечении определенного периода времени.
Ионообменные фильтры
Данный метод умягчения по принципу действия в значительной мере аналогичен описанному выше. Замещение ионов, обуславливающих жесткость воды, в них происходит с помощью многокомпонентных смол типа Ecomix или Ecotar. В состав этих фильтрующих загрузок входят следующие материалы:
- Смола инертная обеспечивает обезжелезивание воды.
- FerroSorb удаляет соединения железа и марганца.
- HumiSorb нейтрализация органических примесей.
- Смола ионообменная для умягчения воды.
- Песок кварцевый в виде подложки, обеспечивающей равномерное распределение потоков жидкости.
Применение многокомпонентных составов для фильтрующих установок позволяет снизить общую жесткость воды за счет реакции замещения катионов кальция и магния. Данная технология более универсальна в сравнении с фильтрами умягчения, однако и менее эффективна. При этом финансовые затраты на ее приобретение и содержание выше нежели у специализированных элементов.
Обратный осмос
Использование полупроницаемых мембран обеспечивает высочайший уровень очистки жидкости от всех видов примесей. В современных системах обратного осмоса показатели общей жесткости воды после кондиционирования на мембранах типа DRO-4040 или DRO-8040 снижаются более чем на порядок. Такие установки применяются для опреснения соленых воды (океанских, морских, озерных и подземных).
Мембраны имеют пористую структур, пропускающую только молекулы воды и задерживающую соединения кальция и магния (гидрокарбонатные и соли кислот). В результате происходит снижение общей жесткости воды до значений, делающих возможным ее применение в фармацевтике и микроэлектронике. Пермеат практически не содержит микроэлементов и нуждается в минерализации для питья и приготовления пищи.
Такие показатели, существенно превосходящие ГОСТ для питьевой воды по общей жесткости, явно избыточны. С учетом высоких начальных затрат на приобретение, монтаж и последующее обслуживание использовать установки обратного осмоса в быту экономически невыгодно. Гораздо эффективнее для таких целей применять традиционные фильтры умягчения.
Как определить жесткость воды с помощью специальных приборов
Вода должна иметь оптимальный показатель жесткости, поскольку полное отсутствие солей вредно для организма человека. Если в воде, например, мало карбонатных солей, это ведет к появлению сердечнососудистых заболеваний.
Если говорить о самих емкостях, в которых вода нагревается, то мягкая вода способствует коррозии. Поэтому после работы оборудования с мягкой водой в теплоэнергетике поверхности дополнительно обрабатывают раствором, содержащим вещества, которые замедляют этот процесс.
Таким образом, вода, из какого источника вы бы ее ни взяли, имеет какой-то показатель жесткости, причем идеально, если он имеет среднее значение, ведь как избыток солей, так и их недостаток ведут к определенным последствиям.
Определить жесткость воды в наше время несложно – сейчас можно приобрести специальные приспособления для контроля этого показателя и в доме, и на производстве. Оптимальный вариант – прибор TDS-3, на рынке его можно встретить под разными торговыми названиями.
Можно использовать другое приспособление, которое позволяет определить жесткость воды, –электролизер. Это достаточно дешевый прибор.
Электорлизер не сможет определить уровень жесткости воды в цифрах, но он окрасит жидкость в определенный цвет в зависимости от того, насколько в ней много соли. После электролиза вы поймете, с какими именно примесями имеете дело также по цвету воды.
Подобный прибор вы можете изготовить сами, для этого возьмите:
- нержавеющую сталь, размер 50 х 50 см;
- болты М6 х 150;
- шайбы;
- гайки;
- прозрачную трубку;
- штуцеры;
- пластиковый контейнер объемом полтора литра;
- фильтр для очистки воды;
- обратный клапан для воды.
Основой для будущего прибора будет служить лист нержавейки, идеально — AISI 316L, если она импортная, и 03Х16Н15М3, если она отечественная.
Теперь нержавейку нужно разметить и разрезать на 16 одинаковых квадратов, после чего у каждого из них срезаем один угол, а на противоположном углу сверлим дырку, которая пригодится чуть позже. Принцип работы электролизера заключается в движении электричества от пластины одного заряда к пластине противоположного заряда, как итог – вода распадается на кислород и водород.
Для того чтобы создать хорошее движение тока, пластины подключают поочередно: сначала положительный заряд, затем отрицательный, снова положительный и т. д. Трубка применяется для изоляции, от нее нужно отрезать кольцо, разрезав которое получаем полоску толщиной 1 мм.
Шайбы нужны для того, чтобы собрать пластины: на болт прикручиваем шайбу, потом пластину и три шайбы, потом снова пластина и так далее. На каждом заряде должно быть по восемь пластин. Все это нужно делать достаточно аккуратно, чтобы избежать соприкосновения спилов пластин с электродами.
Следующий этап создания прибора для определения качества воды – стягивание гаек и изоляция пластин, после чего помещаем то, что получилось, в пластмассовый контейнер подходящего размера.
В местах касания болтами стен бокса сверлим две дыры. Может получиться так, что болты не проходят в ёмкость, тогда обрежьте их и затяните для герметичности гайками. Теперь сверлим отверстие в крышке для штуцеров. Для создания герметичности шва обрабатываем его силиконовым герметиком.
До того как вы соберетесь определить жесткость воды таким прибором, нужно проверить, достаточно ли хорошо он работает: подключите прибор к питанию, наполните водой до болтов, накройте крышкой, подключите к штуцеру трубку и опустите другой конец трубки в воду. Если ток появится, то его можно увидеть.
Теперь ток постепенно нужно увеличивать. Дистиллированная вода из-за своей чистоты очень плохо проводит ток, поэтому для создания электролита в нее нужно добавить щелочь, например, гидроксид натрия (присутствует в средствах для очистки труб типа «Крот»). Защитный клапан предотвращает излишнее скопление газов. Поздравляем, у вас есть собственноручно изготовленный прибор, который позволит определить жесткость воды!
Читайте материал по теме: Фильтр под раковину: рекомендации по выбору
Что такое общая жесткость воды
Получив представление о жесткости воды, и как она влияет на организм, а также на бытовую технику и другое оборудование, приходим к выводу о необходимости ее нормализации. Кустарные методы (кипячение или химобработка) не обеспечивают надлежащего качества воды. Кардинальное решение проблемы возможно только при использовании современных фильтрационных установок.
Компания Diasel Enginereeng предлагает высокоэффективные системы водоподготовки: фильтры умягчения и ионообменные, а также обратноосмотические. Мы предоставляем полный комплекс услуг по проектированию установок, подбору, монтажу и запуску оборудования. Наши специалисты обеспечивают их сервисное и гарантийное обслуживание. Перейти в раздел «Контакты».
Характеристики жесткой воды
Для организма человека жесткая вода с большим содержанием кальция становится даже полезной, так как она наполняет его жизненно важным для костей элементом. Но помимо этого жесткая вода может спровоцировать формирование камней в мочевыводящих каналах и в почках, а мягкая – повышает риск возникновения сердечнососудистой патологии
При умывании кожи жесткой водой она начинает сушиться, а при использовании мыла оно плохо пенится. На трубах и чайниках быстро образуется накипь. Но и мягкая вода не так полезна, как кажется – её использование может спровоцировать коррозию труб и других устройств.
Для бытовых приборов большая жесткость воды часто оказывается губительной, особенно для стиральных машин. Для предупреждения поломки машинки или электрического чайника необходимо использовать в быту фильтры для воды. При поломке ремонт будет стоить недешево, поэтому лучше заранее уберечься от ненужных растрат.
В высокоминерализованной воде концентрация ионов магния может равняться нескольким граммам, а в соленой воде – даже десяткам грамм на литр воды.
Что касается сравнения подземных и поверхностных вод, то у последних жесткость намного меньше, зато она подвергается изменениям погоды, максимально увеличиваясь в конце зимы, а уменьшаясь – во время половодья, когда разбавляется дождевыми и талыми водами. Максимальная жесткость отмечена в воде морей и океанов.